摑崌幐挷徢偺徢忬偺昞傟曽偼恖偵傛偭偰堎側傝傑偡偑丄揟宆揑側宱夁偲偟偰偼
丂慜挍婥丂仺媫惈婜丂仺媥懅婜丂仺夞暅婜
偺4抜奒偑侾偮偺僒僀僋儖偲側傝傑偡丅媫惈婜偼偍傛偺俀廡乣俁儢寧偱丄慡宱夁偼俇儢寧乣侾擭乮侾擭敿乯偱偡丅媫惈婜偼梲惈徢忬偑儊僀儞偱丄枬惈婜偼堿惈徢忬偑婲偙傝傗偡偄偲尵傢傟傑偡丅
堦搙嵞敪偡傞偲丄嵞敪偟傗偡偔側傝傑偡丅嵞敪傪孞傝曉偡偨傃偵堿惈徢忬丄擻椡忈奞偑憹壛偟丄媥懅婜丒夞暅婜偑挿堷偔偲尵傢傟偰偄傑偡丅徢忬偑埨掕偟偰傕峈惛恄昦栻偺暈栻傪懕偗傞偺偼丄嵞敪傪杊偓丄偝傜側傞昦忬偺埆壔丒恑峴傪杊偖偨傔偵昁梫側偺偱偡丅
擔杮偱偼丄1996擭偵嵟弶偺旕掕宆峈惛恄昦栻乮戞擇悽戙峈惛恄昦栻丄SGA( second generation
antipsychotics)丄怴婯峈惛恄昦栻乯偲偟偰儕僗儁儕僪儞偑搊応偟丄2001擭偵偼僋僄僠傾僺儞丄儁儘僗僺儘儞丄僆儔儞僓僺儞偑丄2006擭偵偼傾儕僺僾儔僝乕儖偑忋巗偝傟丄墷暷暲傒偺儔僀儞傾僢僾偲側傝傑偟偨丅2008擭偵偼僽儘僫儞僙儕儞偑壛傢傝丄尰嵼丄擔杮偱巊梡壜擻側旕掕宆峈惛恄昦栻偼俇偮偁傝傑偡丅嬤偄彨棃偁偺僋儘僓僺儞傕巊梡偱偒傞擔傕嬤偄傛偆偱偡丅
偨偩丄挿婜梊屻偺夵慞偵娭偟偰尵偊偽丄椺偊偽帺嶦棪偑10%偱偁傞偙偲丄捠忢廇楯偑壜擻偲側偭偨偺偑2妱庛丄嵞敪棪傗嵞擖堾棪偵偮偄偰傕偝偟偨傞慜恑偑側偐偭偨偙偲偐傜丄岠壥偺柺偱偼傑偩傑偩晄廫暘偱偁傞偲寢榑偯偗偞傞傪摼側偄偱偟傚偆丅傑偨丄EPS傗曋旈偺傛偆側暃嶌梡偼梷偊傜傟偮偮偁傞戙傢傝偵丄SGA偑搊応偟偰偐傜懱廳憹壛丄寣摐忋徃側偳儊僞儃儕僢僋栤戣偑怴偨偵晜忋偟丄偦傟傜偺掕婜揑側儌僯僞乕偑昁梫偵側偭偰偒偰偄傑偡丅
儕僗僷僟乕儖
擔杮偱嵟弶偵巗斕偝傟偨旕掕宆峈惛恄昦栻偱偡丅1996擭偐傜忶嵻偑忋巗偝傟敪攧摉弶偐傜傕偺偡偛偄惃偄偱張曽偝傟偰偄傑偟偨丅巗斕屻偺椪彴帋尡偺愊傒廳偹偵傛傝2001擭偵偼堐帩検偺嵟崅梡検偑8mg偐傜6mg偵尭検偝傟傑偟偨丅2002擭偵偼撪暈塼傕壛傢傝傑偟偨丅偙偺塼偼傕偺偡偛偔嬯偄偨傔丄敄傔偰堸傓傛偆偵偲彂偐傟偨愢柧彂傪晅偗偰挷嵻偟傑偡丅愢柧彂偵偼峠拑丄僂乕儘儞拑丄擔杮拑丄僐乕儔偲崿崌偡傞偲娷検偑掅壓偡傞偨傔丄旔偗傞偙偲傕彂偐傟偰偄傑偡丅
寣拞敿尭婜偼栺20帪娫偱偡丅擼撪偱偺敿尭婜偼偝傜偵挿偄偲傕尵傢傟偰偄傑偡丅PK揑偵偼1擔2夞偱偼側偔1擔1夞搳梌偱傕傛偝偦偆偱偡偑丄敪攧摉弶丄婲棫惈掅寣埑偑寽擮偝傟偨偨傔1擔2夞搳梌偑悇彠偝傟偨傛偆偱偡丅
億僀儞僩侾
揧晅暥彂偺梡検偲丄椪彴偱偺巊梡幚懺偑堦抳偟偰偄側偄偙偲偑偁傞
乣儕僗僷僟乕儖偺椪彴偱巊梡偝傟傞梡検偵偮偄偰抦偭偰偍偔丅
丂乮侾乯奐巒帪丂丂乮俀乯媫惈婜丒堐帩婜
偙偺姵幰偺key drug偲巚傢傟傞儕僗僷僟乕儖忶偵偮偄偰丆
乮侾乯奐巒帪丂偲乮俀乯媫惈婜丒堐帩婜丂偵暘偗偰偦偺栻梡検峫偊偰偄偒傑偟傚偆丅
亂儕僗僷僟乕儖忶偺揧晅暥彂傛傝亃
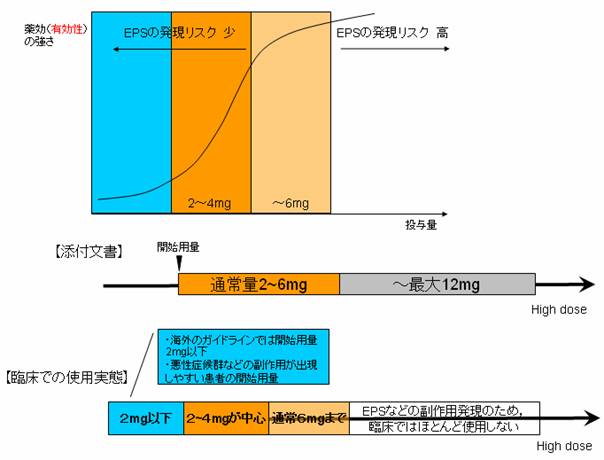
捠忢丄惉恖偵偼儕僗儁儕僪儞偲偟偰1夞1mg1擔2夞傛傝巒傔丄彊乆偵憹検偡傞丅堐帩検偼捠忢1擔2乣6mg傪尨懃偲偟偰1擔2夞偵暘偗偰宱岥搳梌偡傞丅側偍丄擭楊丄徢忬偵傛傝揔媂憹尭偡傞丅扐偟丄1擔検偼12mg傪偙偊側偄偙偲丅
乮侾乯奐巒帪
揧晅暥彂忋偺奐巒梡検偼2mg偱偡丅奀奜偺僈僀僪儔僀儞偱偼弶敪椺偵偼0.5-1mg丄嵞敪椺偵偼1-2mg掱搙偐傜奐巒偡傞偲偝傟偰偄傑偡丅6擭嬤偔挷嵻偐傜棧傟偰偟傑偭偰偍傝丆擔杮偱偺奐巒梡検偺幚懺傪巹偼抦傝傑偣傫丅偄偢傟曌嫮偟偰棟夝偡傞傛偆偵偟偨偄偲巚偄傑偡丅傑偢丄奐巒梡検傕揧晅暥彂偺検傛傝彮側偄偐傕丆偲偄偆偙偲傪偍揱偊偟傑偡丅
摉堾偺張曽棜楌偐傜傒偨丄偙偺姵幰偺奐巒梡検偼6mg偱偟偨丅
摉堾偱偺栻楌乮愒帤丗張曽曄峏乯
|
|
2008.7乮弶恌乯乣 |
|
儕僗僷僟乕儖忶乮1mg乯 |
6T丂3Xnde丂35擔暘丂 |
|
傾僉僱僩儞忶乮1mg乯 |
3T丂俁Xnde丂35擔暘 |
|
僙儘僋僄儖忶乮100mg乯 |
2T丂俀XM.A丂35擔暘 |
峫偊傜傟傞張曽攚宨偼丆埲壓偺傛偆偵側傝傑偡丅
丒弶敪乯6mg偱帯椕傪奐巒偟偨
丒弶敪乯媫惈婜帯椕偱丆懍傗偐偵徢忬傪梷偊傞偨傔Loading dose朄傪峴偭偰偄傞
丒嵞敪乯懠堾偱婛偵搳栻傪庴偗偰偄偰丆徢忬埆壔偺偨傔摉堾奜棃傪庴恌
亙崅梡検6mg偱帯椕傪奐巒偟偨壜擻惈偑掅偄偙偲偵偮偄偰亜
婲棫惈掅寣埑偑尰傟傞偙偲偑偁傞偨傔丄揧暥偱傕乽彊乆偵憹検偡傞乿偲彂偄偰偁傝傑偡丅偄偒側傝6mg傪搳梌偡傞壜擻惈偼旕忢偵掅偄偲巚偄傑偡丅
亙媫惈婜偵偍偗傞儕僗僷僟乕儖忶偺Loading偵偮偄偰亜
偄偪憗偔岠壥傪摼偨偄偲偒偵Loading偑峴傢傟傞偙偲偑偁傝傑偡丅峈惛恄昦栻偺拞偱偼儕僗僷僟乕儖乭塼乭傪拞怱偵丄惛恄壢媬媫偺尰応偱Loading偑峴傢傟傞偙偲偑偁傞傛偆偱偡丅SGA偑搊応偡傞慜偼僐儞僩儈儞嬝拲偑巊梡偝傟偰偄偨傛偆偱偡偑丄儕僗僷僟乕儖塼偼寣拞擹搙偺棫偪忋偑傝偑憗偔丄僐儞僩儈儞嬝拲偲摨摍偺懄岠惈傪桳偟偰偄傑偡丅
偟偐偟丄帯椕弶婜偐傜崅梡検傪梡偄傟偽丄EPA側偳偺暃嶌梡敪尰儕僗僋偑崅偔側傝傑偡丅摑崌幐挷徢偺帯椕偼挿婜偵搉傝傑偡偐傜丄偄偐偵姵幰偑栻偵懳偟偰嫅愨姶傪帩偨側偄傛偆偵偟丄傾僪僸儔儞僗傪崅傔傞偙偲偑昁梫偱偡丅傛偭偰丄峈惛恄昦栻偺Loading偼埨堈偵偱峴傢傟傞帯椕曽朄偱偼側偄偲巚偄傑偡丅
乮嶲峫乯峈寣彫斅栻偺Loading偼峀偔椪彴偱峴傢傟偰偄傑偡偺偱丄偙偺婡夛偵曌嫮偟偰偍偔偲偄偄偱偟傚偆丅
億僀儞僩俀
峈惛恄昦栻偺岠壥敪尰帪婜偵偮偄偰棟夝偡傞丅
媫懍側捔惷偑昁梫偱偁傟偽俛倅俹宯偺栻嵻傪暪梡偡傞側偳丄懠偺庤抜傪峫椂偡傞偲偄偆峫偊偑尰嵼偺庡棳偱偁傞傛偆偱偡丅摑崌幐挷徢偺帯椕偼峈惛恄昦栻偩偗偱帯椕偡傞偺偱偼側偔丆姵幰偺徢忬偵崌傢偣偰丆峈晄埨嶌梡傗悋柊嶌梡傪慱偭偨BZP宯栻嵻偺暪梡傗丆婥暘埨掕栻傗峈偆偮栻偺暪梡偑峴傢傟偰偄傑偡丅
乮曗懌乯摑崌幐挷徢偺帯椕偲偟偰丄峈惛恄昦栻偵僨僷働儞丄僥僌儗僩乕儖丄儕乕儅僗側偳偺婥暘埨掕栻偑暪梡偝傟傞偙偲偑偁傝傑偡丅婥暘埨掕栻傪梡偄傞偙偲偱忣摦偺埨掕壔傪偼偐傞偲丄峈惛恄昦栻偺僞乕僎僢僩徢忬偱偁傞巚峫忈奞偺夵慞偑摼傜傟傗偡偔側傞壜擻惈偑偁傞偲愢柧偝傟偰偄傑偡丅峈惛恄昦栻偵婥暘埨掕栻傪壛偊傞偙偲偺桳梡惈偼偁傞偐傕偟傟傑偣傫偑丄僄價僨儞僗偲偟偰妋棫偝傟偰偄傞傢偗偱偼偁傝傑偣傫丅
亙懠堾偱婛偵搳栻傪庴偗偰偄偰丆徢忬埆壔偺偨傔摉堾奜棃傪庴恌偟偨壜擻惈偵偮偄偰亜
惛恄壢偱偺椪彴宱尡偑慡偔側偄傕偺偱偡偐傜帺怣偼偁傝傑偣傫偑丄奐巒梡検偐傜峫偊傞偲丄婛偵懠堾偱儕僗僷僟乕儖偺搳梌傪庴偗偰偄偨壜擻惈偑崅偄偲悇應偟傑偡丅
乮俀乯媫惈婜丒堐帩婜
暃嶌梡偺敪尰傪嵟彫尷偵梷偊丆峈惛恄昦嶌梡傪堷偒弌偣傞帯椕堟偼丆擭乆掅梡検壔偟偰偒偰偍傝丆堐帩帯椕偱梡偄傞儕僗僷僟乕儖忶偺梡検偼尰嵼俀乣係mg偱偁傞偲峫偊傜傟偰偄傑偡丅
偦偟偰4mg傪挻偊傞偲桳岠惈傕婜懸偱偒傑偡偑丆暃嶌梡敪尰偺儕僗僋傕崅偔側傝丆桳岠惈偲埨慡惈偺僶儔儞僗偑曵傟偰偄偔傛偆偱偡丅6mg傑偱偼桳岠惈偑憹偡偙偲偺儊儕僢僩偑暃嶌梡儕僗僋傪忋夞傞傛偆偱偡丅
揧晅暥彂偺婰嵹偱偼12mg傑偱巊梡偱偒傞偙偲偵側偭偰偄傑偡偑丆6mg傪挻偊傑偡偲暃嶌梡敪尰偺僨儊儕僢僩偑桳岠惈偺儊儕僢僩傪壓夞傝丆儕僗僷僟乕儖偺帩偪枴偑幐傢傟偰偟傑偄傑偡偺偱椪彴偺尰応偱偼6mg傑偱偺巊梡偲側偭偰偄傞偺偑幚懺偱偡丅
戞擇悽戙峈惛恄昦栻偵傛傞堐帩帯椕偵偮偄偰偺専摙偼枹偩廫暘偱側偔丄摿偵乽嵟掅堐帩搳梌検乿偵偮偄偰偼傛偔傢偐偭偰偄傑偣傫偑丄儕僗僷僟乕儖偵偍偄偰偼3mg掱搙偁傞偄偼偦傟埲壓偺梡検偱堐帩帯椕偑偱偒傞壜擻惈偑偁傞偲尵傢傟偰偄傑偡丅
億僀儞僩俁
媫惈婜帯椕偐傜堐帩帯椕傊偺堏峴偺巇曽偵偮偄偰棟夝偡傞丅
6mg偲偄偆搳梌検偐傜峫偊偰媫惈婜乣堐帩帯椕傊偺堏峴拞偱偁傞偲峫偊傜傟傑偡丅堐帩婜傊偺堏峴偺巇曽偱偡偑丆媫惈婜傪夁偓偨屻傕 6儢寧偼摨偠梡検偱帯椕傪懕偗丄偦偺屻偵6儢寧偛偲偵栺20%偢偮尭検偡傞曽朄偑偁傝傑偡丅
偙傟偑愨懳揑側曽朄偲偄偆傢偗偱偼偁傝傑偣傫偑丄峈惛恄昦栻偺堐帩椕朄傊偺堏峴偼偐側傝備偭偔傝偲峴傢傟傞偲偄偆偙偲偱偡丅僾儗僪僯儞偺tapering偑悢擔扨埵偱峴傢傟偰偄偔偺偲偼懳徠揑偱偁傝丆慟尭曽朄傕栻嵻偵傛傝條乆偲偄偆偙偲偵拲堄偟偰偔偩偝偄丅
乮曗懌乯搳梌奐巒帪偺慟憹偺曽朄偵偮偄偰偼忣曬偑朢偟偄偺偱偡偑丆儕僗僷僟乕儖0.5mg/廡偺憹検儁乕僗偑EPS傗婲棫惈掅寣埑偺弌尰杊巭偺娤揰偐傜朷傑偟偄偲彂偐傟偰偄傞杮偑偁傝傑偡丅慟尭傛傝儁乕僗偑懍偄偱偡丅
億僀儞僩係
儕僗僷僟乕儖偺暃嶌梡偲懳張曽朄偵偮偄偰棟夝偡傞
乮侾乯僪僷儈儞庴梕懱幷抐偵傛傞庡嶌梡丒暃嶌梡傪丄擼撪偺4偮偺宱楬偵暘偗偰棟夝偡傞
乮俀乯悕懱奜楬徢忬偺庡側庬椶偲懳張曽朄偵偮偄偰棟夝偡傞
乮俁乯悕懱奜楬徢忬偵懳偡傞丄峈僐儕儞惈僷乕僉儞僜儞栻偺揔惓巊梡偵偮偄偰棟夝偡傞
乮係乯悕懱奜楬徢忬埲奜偺暃嶌梡偵偮偄偰
儕僗僷僟乕儖偑崅梡検乮6mg乯偱偁傞偙偲偐傜丆 傾僉僱僩儞偼EPS偵懳偡傞張曽偱偁偭偨偲峫偊傑偡丅梊杊搳梌側偺偐丆徢忬偑敪尰偟偰偄偰偺帯椕偑栚揑側偺偐偼晄柧偱偡丅
乮侾乯僪僷儈儞庴梕懱幷抐偵婎偯偔庡嶌梡丒暃嶌梡傪丄擼撪偺4偮偺宱楬偵暘偗偰棟夝偡傞
摑崌幐挷徢偺帯椕栻偼丄D2庴梕懱幷抐嶌梡傪僐儞僙僾僩偵偟偰奐敪偝傟偰偒傑偟偨丅偟偐偟丄僪乕僷儈儞恄宱傪幷抐偟偰偟傑偆偙偲偑丄峈惛恄昦栻偺栻棟嶌梡偱偁傝丄暃嶌梡偱傕偁傝傑偡丅FGA偱偼摿偵僪僷儈儞庴梕懱幷抐偵傛傞悕懱奜楬徢忬 [extrapyramidal symptoms(EPS)]偑栤戣偲偝傟偰偒傑偟偨丅
擼撪僪僷儈儞宱楬偼係偮偁傞偙偲偑抦傜傟偰偄傑偡丅偙偺4偮偺恄宱宱楬偵暘偗偰岠壥偲暃嶌梡傪惍棟偟傑偟傚偆丅拞擼曈墢宯乬埲奜乭偵嶌梡偟偨栻嵻偺 D2庴梕懱幷抐嶌梡偼丄暃嶌梡偺尨場偲側傝傑偡丅
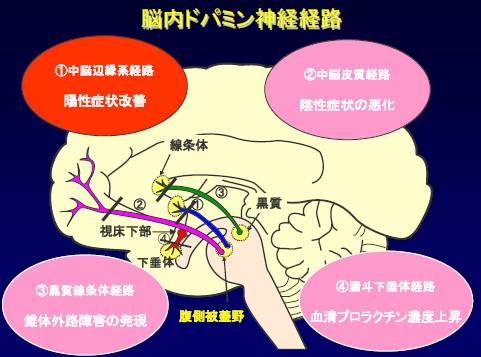
嘆 拞擼乗曈墢宯丂丂梲惈徢忬偺夵慞
嘇 拞擼乗旂幙宯丂丂堿惈徢忬傪埆壔偝偣傞嫲傟
嘊 崟幙乗慄忦懱宯丂悕懱奜楬徢忬
嘋 帇彴壓晹丂丂丂丂崅僾儘儔僋僠儞寣徢
亂SGA偺暃嶌梡偑寉尭偝傟偰偄傞棟桼亃
廬棃偺掕宆峈惛恄昦栻偱偼丄堿惈徢忬偵廫暘側岠壥傪敪婗偡傞偙偲偑偱偒偢丄埆壔偝偣傞応崌傕偁傞偲尵傢傟傑偡丅傑偨丆摿偵栤戣偱偁偭偨偺偑EPS側偳偺暃嶌梡偑懡偄偙偲偱偟偨丅SGA偱偼堿惈徢忬偺夵慞嶌梡偑偁傝丆EPS偺敪尰昿搙偑掅偄偲尵傢傟偰偄傑偡丅棟桼偼壗偱偟傚偆偐丅
棟桼侾乯丂旂幙宯丆慄忦懱宯傊慖戰揑側5HT2庴梕懱幷抐嶌梡
SDA偼D2庴梕懱幷抐嶌梡偲丄5HT2庴梕懱幷抐嶌梡傪暪偣傕偪傑偡丅僙儘僩僯儞嶌摦惈恄宱偼嘇旂幙宯偍傛傃嘊慄忦懱宯傊搳幩偟偰偍傝丄5HT2庴梕懱傪夘偟偰僪僷儈儞偺梀棧傪梷惂偟偰偄傞偨傔丄5HT2庴梕懱幷抐嶌梡偼僪僷儈儞偺梀棧傪懀恑偡傞偙偲偵側傝傑偡丅儕僗儁儕僪儞偼丂D2庴梕懱幷抐嶌梡丂亙丂5HT2庴梕懱幷抐嶌梡丂偱偁傝丄堿惈徢忬偺埆壔偑側偔丄EPS偺敪尰傪梷偊傜傟傞偲愢柧偝傟偰偄傑偡丅
側偍丄嘆曈墢宯偱偼僙儘僩僯儞嶌摦惈恄宱偺娭梌偼寉旝偱偁傝丄梲惈徢忬偵懳偡傞嶌梡偺尭庛偼婲偙傜側偄偲偝傟偰偄傑偡丅
棟桼2乯庴梕懱傊偺偔偭偮偒曽丒愯桳棪偐傜
EPS側偳偺暃嶌梡偺敪尰傪嵟彫尷偵梷偊帯椕岠壥傪摼傞偨傔偵偼丄慄忦懱偵偍偗傞D俀庴梕懱偺愯嫆棪偑65乣80%偱偁傞偙偲偲尵傢傟偰偄傑偡丅80%傪挻偊傞偲暃嶌梡偑敪尰偟傗偡偔側傝傑偡丅SGA偺D2庴梕懱偵懳偡傞寢崌偺巇曽偼堎側偭偰偍傝丄暃嶌梡偺敪尰昿搙偵戝偒偔塭嬁偟偰偄傑偡丅
儕僗僷僟乕儖丂D2庴梕懱偵嫮偔丄偐偮帩懕揑偵寢崌
儖乕儔儞丂丂丂寢崌偼嫮偄偑丄堦夁惈
僙儘僋僄儖丂丂寢崌偑娚偔丄偐偮堦夁惈
僕僾儗僉僒丂丂寢崌偑娚偄偑帩懕揑
乮俀乯悕懱奜楬徢忬偺庡側庬椶偲懳張曽朄偵偮偄偰棟夝偡傞
搳梌奐巒屻憗婜偵尰傟傞媫惈偺悕懱奜楬徢忬偲丄挿婜搳梌偱弌尰偡傞抶敪惈偺悕懱奜楬徢忬偑偁傝傑偡丅峈惛恄昦栻暈梡幰偺50乣70亾偵擣傔傜傟傞偲尵傢傟偰偄傑偡丅
|
媫惈 |
抶敪惈 |
|
傾僇僔僕傾 |
抶敪惈僕僗僉僱僕傾 |
傾僇僔僕傾乮惷嵗晄擻徢乯
|
徢忬 |
乽偠偭偲偟偰偄傜傟側偄丄懌偑儉僘儉僘偡傞乿側偳偺堎忢側姶妎傪帺妎偟丄晄柊丄晄埨丄徟憞姶傪敽偆偙偲偑懡偔丄惛恄徢忬偲偺娪暿偑昁梫偱偡丅 |
|
敪徢帪婜 |
帯椕奐巒屻3乣12廡偱弌尰偟傗偡偄 |
|
敪徢偟傗偡偄恖丂 |
拞擭丄彈惈 |
|
懳張曽朄 |
傾僇僔僕傾偺昦懺偼枹偩廩暘夝柧偝傟偰偄傑偣傫丅峈僷乕僉儞僜儞昦栻偑岠偒偵偔偄偲尵傢傟丆BZP宯偑巊梡偝傟傑偡丅側偤丄BZP宯栻嵻偑岠壥傪帵偡偺偐偼柧傜偐偵偝傟偰偄傑偣傫丅 |
僷乕僉儞僜僯僘儉
|
徢忬 |
嬝屌弅丄怳愴丄柍摦乮傾僉僱僕傾乯傪俁挜岓偲偡傞丅偡傋偰偑懙偆偙偲偼彮側偔柍摦仺屌弅仺怳愴偺弴偱敪尰偡傞偙偲偑懡偄丅柍摦偼堿惈徢忬偲梷偆偮徢忬偲偺娪暿偑昁梫丅 |
|
敪徢帪婜 |
峈惛恄昦栻奐巒屻栺4乣10廡偑敪尰偺僺乕僋 |
|
敪徢偟傗偡偄恖丂 |
崅楊幰丄彈惈丄旕媔墝幰 |
|
懳張曽朄丂 |
崅椡壙孮偺栻偱偼峈僐儕儞惈偺僷乕僉儞僜儞昦乮PD乯帯椕栻偺暪梡傕傗傓偍偊傑偣傫丅偟偐偟丄旕掕宆峈惛恄昦栻偱偼EPS偑惗偠偨偲偒偵撢梡偡傞掱搙偱懌傝傑偡丅梊杊搳梌偼偱偒傞偩偗峴偄傑偣傫丅 |
媫惈僕僗僩僯傾
|
徢忬 |
媫惈僕僗僩僯傾偼丄娽媴忋揮乮崟栚偑堄巚偲偼柍娭學偵忋傪岦偄偰偟傑偆乯丄愩丒栩晹丒懱姴偺偹偠傟傗撍偭挘傝偑摿挜揑偱偁傞丅 |
|
敪徢帪婜 敪尰昿搙 |
丒峈惛恄昦栻傪奐巒偟偰悢帪娫偐傜悢擔偺娫偵傕偭偲傕婲偙傝傗偡偄丅擔撪曄摦偁傝丄屵屻丄摿偵梉曽偵婲偙傝傗偡偄 |
| 敪徢偟傗偡偄恖丂 |
30嵨傛傝庒偄抝惈偱偺嬝擏撪拲幩偱惗偠傗偡偄丅 |
| 懳張曽朄丂 |
峈僐儕儞栻乮價儁儕僨儞乯偺嬝拲偱乬寑揑偵乭夵慞偡傞偲偄傢傟偰偄傞丅丅儀儞僝僕傾僛僺儞乮僕傾僛僷儉乯偺惷拲傕桳岠丅媫惈僕僗僩僯傾偺婲偙傞儕僗僋偺崅偄応崌丄峈僐儕儞惈僷乕僉儞僜儞栻偺梊杊搳梌偑専摙偝傟傞偙偲偼偁傝傑偡丅 |
抶敪惈僕僗僉僱僕傾
|
徢忬 |
岥怬傗愩傪儌僌儌僌摦偐偡傛偆側岥廃埻偺晄悘堄塣摦偑傎偲傫偳偱偁傞丅 |
|
敪徢帪婜 |
椵愊敪徢棪偼1擭偱5亾丄2擭偱10亾丄3擭偱15亾丄4擭偱19亾丅 |
|
敪徢偟傗偡偄恖丂 |
廬棃宆峈惛恄昦栻偺挿婜暈梡拞偺姵幰偵擣傔傜傟傞丅 |
|
懳張曽朄丂 |
崻帯揑帯椕朄偼側偄丅偦偺偨傔梊杊偵椡傪拲偖丅 |
乮俁乯悕懱奜楬徢忬偵懳偡傞丄峈僐儕儞惈偺僷乕僉儞僜儞栻偺揔惓巊梡偵偮偄偰棟夝偡傞
堦尵偱EPS偲尵偭偰傕丆僷乕僉儞僜僯僘儉傗媫惈僕僗僩僯傾偵懳偟偰偼峈僐儕儞惈僷乕僉儞僜儞偺岠壥偑婜懸偱偒傞偑丆傾僇僔僕傾傗抶敪惈僕僗僉僱僕傾偵偼岠偒偵偔偄丒岠偐側偄偙偲傪棟夝偟傑偡丅
崟幙慄忦懱宯偺乬D俀乭庴梕懱傪幷抐偟偰婲偙傞EPS偵懳偟丄壗屘乬峈僐儕儞惈乭僷乕僉儞僜儞栻傪搳梌偡傞偺偱偟傚偆偐丠偦傟偼丄擼撪偺僪乕僷儈儞偲傾僙僠儖僐儕儞偺乬僶儔儞僗乭偑曵傟傞偙偲偑尨場偲峫偊傜傟偰偄傞偐傜偱偡丅側偍丆傾乕僥儞傗傾僉僱僩儞偼丄尰嵼PD偺帯椕偵娭偟偰偼曗彆揑側栶妱偲側偭偰偄傑偡丅
侾乯梊杊搳梌偼昁梫偐丠
暃嶌梡偵懳偡傞栻嵻偺搳梌偼丄
暃嶌梡偺尨場偲側傞栻暔傪奐巒偡傞偲摨帪偵梊杊搳梌傪奐巒偡傞応崌偲丄
暃嶌梡偑敪尰偡傞傑偱梊杊搳梌傪偱偒傞偩偗峴傢側偄応崌偑偁傝傑偡丅
峈惛恄昦栻偺EPS偵懳偡傞峈僐儕儞惈僷乕僉儞僜儞栻偺搳梌偼婎杮揑偵屻幰偱峴傢傟傑偡丅
EPS偑敪尰偟偨偲偒偼丄傑偢峈惛恄昦栻偺尭検傗丄懠栻傊偺曄峏傪専摙偟丄偦傟偱傕偩傔側傜僷乕僉儞僜儞栻傪搳梌偟傑偡丅巊梡傪奐巒偟偰偐傜傕丄枱慠偲搳梌傪宲懕偣偢丄巭傔帪傪尒寁傜偆偙偲傕廳梫偱偡丅
亂峈僐儕儞惈僷乕僉儞僜儞栻偺埆偄揰亃
丒峈僷乕僉儞僜儞栻帺懱偵暃嶌梡偑偁傞
丂丂丂乣摑崌幐挷徢偺徢忬偵懳偡傞暃嶌梡偲偟偰偼丄梡検埶懚揑偵擣抦婡擻忈奞丄摿偵婰壇忈奞傗拲堄婡擻傪掅丂丂丂丂壓偝偣傞壜擻惈偑偁傞
丒棎梡傗埶懚偺儕僗僋乮峈僐儕儞栻偵偼婥暘崅梘嶌梡傗懡岾姶傪惗偠偣傞偙偲偑偁傞乯
丒挿婜搳梌偵傛傝抶敪惈僕僗僉僱僕傾傪庝婲偟傗偡偔偡傞壜擻惈
峈僐儕儞惈僷乕僉儞僜儞栻偵傛傞婰壇忈奞偼壜媡揑偱丄搳梌拞巭偵傛傝夵慞偟傑偡丅1擭埲忋偵傢偨傝栻嵻傪搳梌偝傟偰偄偰傕丄拞巭10擔屻偵偼婰壇婡擻偺夵慞偑帵偝傟偨曬崘傕偁傝傑偡丅捠忢偺巊梡検偩偲丄栺10%掱搙偺擣抦婡擻偺掅壓偑偁傞偲傕尵傢傟偰偄傑偡丅
傾乕僥儞傗傾僉僱僩儞偑巊梡偱偒側偄応崌丄僺儗僠傾傕慖戰巿偺堦偮偵側傝傑偡丅偨偩偟丄傾僉僱僩儞側偳偵斾傋俤俹俽偵懳偡傞嶌梡偼庛偄偲尵傢傟偰偄傑偡丅
亂傾乕僥儞偲傾僉僱僩儞偺巊偄暘偗偵偮偄偰亃
寢榑傪愭偵尵偊偽丄戝嵎偼側偄偲尵偊傑偡丅
傾僉僱僩儞偼1擔1夞偺搳梌偱傕壜偱偡丅傾僉僱僩儞偵偼拲幩偑偁傝傑偡偑傾乕僥儞偵偼偁傝傑偣傫丅
傾僉僱僩儞偼傾乕僥儞傛傝慄忦懱偵偁傞俵侾庴梕懱偵懳偡傞慖戰惈偑崅偔丄怱嬝傗崪奿嬝偵偁傞俵俀庴梕懱丄挵娗暯妸嬝偵偁傞M3庴梕懱傪夘偡傞枛徑惈偺暃嶌梡偑彮側偄壜擻惈偑偁傞偲偄傢傟偰偄傑偡丅偟偐偟寢嬊偺偲偙傠椪彴揑側嵎偼側偄偲偄偆偙偲偱偡丅
乮曗懌侾乯悕懱奜楬徢忬傪婲偙偡壜擻惈偺偁傞栻嵻傪乽億働僢僩堛栻昳廤乿偱妋擣偟偰偍偒傑偟傚偆丅
乮曗懌2乯栻暔椕朄偺昡壙偵偼丄僶儕僨乕僩偝傟偨昡壙曽朄偑偁傞偙偲傪抦傞
栻暔椕朄偺僾儔儞傪棫偰偨偁偲偦傟傪幚峴偟傑偡偑丄偦偺屻偺惓妋側昡壙偑昁梫偱偡丅SOAP偺A乮Assessment乯偱偡丅曋旈偵懳偟曋捠偑偁偭偨丒側偐偭偨偲偄偆娙扨側昡壙曽朄偱偒傞傕偺偺傎偐偵丄俤俹俽偵懳偟偰偼傛傝愱栧惈偺崅偄僶儕僨乕僩偝傟偨昡壙曽朄偑偁傞偙偲傪抦傝丄応崌偵傛偭偰偼巊偊傞傛偆偵偡傞偙偲偑拞寴埲忋偺栻嵻巘偵媮傔傜傟傑偡丅
|
俽 |
姵幰偑捈愙採嫙偡傞暃嶌梡徢忬側偳栻偵娭偡傞 |
|
俷 |
尰嵼偺姵幰偲栻暔椕朄偺幚懺丗丂 |
|
俙 |
栻嵻巘偲偟偰偺昡壙丒夞摎丗丂 |
|
俹 |
栻暔椕朄偺僾儔儞僯儞僌丗丂 |
崱偼栻嵻巘偲偟偰偺婎慴傪屌傔傞帪婜偱偡偐傜丄昡壙僣乕儖偺柤慜傪侾偮偩偗徯夘偟偰偍偒傑偡丅
|
昡壙崁栚 |
昡壙曽朄 |
旛峫 |
|
栻尨惈悕懱奜楬徢忬 |
栻尨惈悕懱奜楬徢忬昡壙広搙DIEPSS丗Drug Induced Extrapyramidal Symptoms Scales |
弉楙偟偨媄弍偑昁梫 暷崙偺惛恄壢椞堟偺栻嵻巘偼偡偱偵偙偺昡壙広搙傪梡偄偰儖乕僠儞揑偵暃嶌梡偺昡壙傪峴偭偰偄傞偦偆偱偡丅 |
側偍丄婛偵夝愢傪廔偊偨偆偮昦傗僋儘乕儞昦偵傕僶儕僨乕僩偝傟偨昡壙僣乕儖偑偁傞偺偱偡偑丄帪婜彯憗偲峫偊偨偨傔愢柧傪堦愗徣棯偟偰偄傑偡丅
乮係乯EPS埲奜偺暃嶌梡偵偮偄偰
峈惛恄昦栻偼丄僪僷儈儞庴梕懱幷抐嶌梡埲奜偵傕丄條乆側嶌梡傪桳偡傞丅側偤偐峈偆偮栻偲帡偰偄傑偡丅
|
峈僐儕儞嶌梡 |
曋旈丄攔擜崲擄丄岥妷丄帇椡挷愡忈奞丄 |
|
峈兛1嶌梡 |
婲棫惈掅寣埑丄惈婡擻忈奞 |
|
峈H1嶌梡 |
捔惷丄懱廳憹壛 |
崅僾儘儔僋僠儞寣徢
儕僗僷僟乕儖偼暃嶌梡偑彮側偄偲尵傢傟傞拞偱忋巗偝傟傑偟偨偑丄SGA偺拞偱傕庴梕懱偺寢崌偑嫮偔帩懕揑偱偁傝EPS側偳偺暃嶌梡偑弌傗偡偄栻嵻偱偡丅傑偨丄儕僗僷僟乕儖偼FGA偲摨摍偁傞偄偼偦傟埲忋偵崅僾儘儔僋僠儞寣徢傪婲偙偟傗偡偄偲尵傢傟偰偄傑偡丅
傎傫偺悢擭慜傑偱丄峈惛恄昦栻偵傛傞崅僾儘儔僋僠儞寣徢偼寉帇偝傟偰偄偨傛偆偱偡丅柍寧宱偑側偗傟偽丄偲傝傢偗僾儘儔僋僠儞傪専嵏偟側偔偰傕椙偄偲偄偆姶偠偱偁偭偨偲傕尵傢傟偰偄傑偡丅
側偤丄崅僾儘儔僋僠儞寣徢偑偄偗側偄偺偐愢柧偱偒傞偱偟傚偆偐丠抝惈偱偼杣婲忈奞傪堷偒婲偙偟偨傝丆彈惈偱偼寧宱晄慡摍偺尨場偵側傞偙偲偼抦偭偰偄傞偲巚偄傑偡丅偦偺傎偐丄崅僾儘儔僋僠儞偑挿婜偵傢偨傞偲僄僗僩儘僎儞偺暘斿傪梷惂偟偰崪慹闋徢傪彽偔壜擻惈偑帵嵈偝傟偰偍傝丄偝傜偵丄怱寣娗宯偺昦曄傗丄彈惈偺応崌偼擕娻傗巕媨撪枌徢偑懡偔側傞偲偄傢傟偰偄傑偡丅摑崌幐挷徢偺帯椕栻偼挿婜娫偺暈栻偑昁梫偲側傞偨傔丄偙偺傛偆側挿婜偵搉傞懱傊偺塭嬁傕峫椂偡傋偒偲巚偄傑偡丅
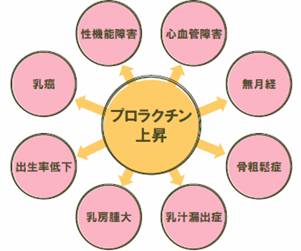
儕僗儁儕僪儞偑尨場偺惈婡擻忈奞偼抝惈偵偍偄偰偼梡検埶懚惈偱偁傞偺偵懳偟丆彈惈偵偦傟偼摉偰偼傑傜側偄偲偄偆僨乕僞偑偁傞傛偆偱偡丅彈惈姵幰偵偍偗傞柍寧宱偑1mg/擔偺梡検偱傕敪尰偡傞偙偲偼椙偔抦傜傟偰偄傞偲偺偙偲偱偡丅偮傑傝丆尭検偟偰傕彈惈偺崅僾儘儔僋僠儞寣徢偼夵慞偟側偄偲偄偆偙偲偑傢偐傝傑偡丅慡偰偺暃嶌梡偵偮偄偰尵偊傞帠偱偡偑丆暃嶌梡偼丆梡検埶懚惈偺暃嶌梡偲丆旕梡検埶懚惈偺暃嶌梡偵暘偗偰棟夝偡傞偙偲偑戝愗偱偡丅
庢傝偆傞懳張朄偲偟偰偼丆
嘆尭栻乮仼抝惈偺応崌乯丆媥栻擔傪愝偗傞丆
嘇惈婡擻忈奞傪堷偒婲偙偡壜擻惈偺掅偄懠嵻傊偺曄峏
偑峫偊傜傟傑偡丅
偦傟偱傕僟儊側傜栻暔帯椕偲偟偰偼僷乕儘僨儖側偳偑峫偊傜傟傑偡偑丆惛恄徢忬偺埆壔傪彽偔偙偲傕偁傝丆摫擖偼怲廳偱偁傞傋偒偱偟傚偆丅娍曽栻偱偁傞鋲栻娒憪搾傪巊梡偡傞偙偲傕偁傞傛偆偱偡丅
僙儘僋僄儖
乮僙儘僋僄儖忶偺揧晅暥彂傛傝乯
乽捠忢丄惉恖偵偼僋僄僠傾僺儞偲偟偰1夞25mg丄1擔2枖偼3夞傛傝搳梌傪奐巒偟丄姵幰偺忬懺偵墳偠偰彊乆偵憹検偡傞丅捠忢丄1擔搳梌検偼150乣600mg偲偟丄2枖偼3夞偵暘偗偰宱岥搳梌偡傞丅側偍丄搳梌検偼擭楊丒徢忬偵傛傝揔媂憹尭偡傞丅偨偩偟丄1擔検偲偟偰750mg傪挻偊側偄偙偲丅乿
偙偺姵幰偺摉堾張曽忋偺奐巒梡検偼200mg偱偡丅
丒弶敪乯200mg偱帯椕傪奐巒偟偨
丒弶敪乯媫惈婜帯椕偱丆懍傗偐偵徢忬傪梷偊傞偨傔loading dose朄傪峴偭偰偄傞
丒嵞敪乯懠堾偱婛偵搳栻傪庴偗偰偄偰丆徢忬埆壔偺偨傔摉堾奜棃傪庴恌
彊乆偵憹検偡傞丆偙偲偑婎杮側偺偱200mg偱偄偒側傝帯椕傪奐巒偟偨壜擻惈偼掅偄偱偡丅
捠忢丄1擔搳梌検偼150乣600mg 偩偐傜丆Loading偺搳梌検偲偟偰偼彮側偄偲巚傢傟傑偡丅
寢嬊丆嵞敪乯懠堾偱婛偵搳栻傪庴偗偰偄偰丆徢忬埆壔偺偨傔摉堾奜棃傪庴恌丆偑壜擻惈偲偟偰堦斣崅偄偱偡丅
億僀儞僩俆
揧旕掕宆峈惛恄昦栻偺拞偱丄僙儘僋僄儖偺埵抲偯偗傪岠壥偺嫮偝偲暃嶌梡偵暘偗偰棟夝偡傞丅
乮侾乯岠壥
慡偰偺峈惛恄昦栻偺拞偱嵟傕D2庴梕懱恊榓惈偑庛偔丄堦搙D2庴梕懱偵寢崌偟偰傕懍傗偐偵夝棧偟丄尰嵼敪攧偝傟偰偄傞峈惛恄昦栻偺拞偱嵟傕EPS偺昿搙偑掅偔丄崅僾儘儔僋僠儞寣徢傕掓偟偵偔偄偲偝傟偰偄傑偡丅偦偺戙傢傝峈惛恄昦嶌梡傕儅僀儖僪側姶偠偱偡丅
摑崌幐挷徢偺徢忬偑寉偔丄暃嶌梡偺彮側偄栻嵻傪媮傔傞姵幰偵偼僙儘僋僄儖偼偍姪傔偱偡丅
梲惈徢忬偑寖偟偄恖偼岦偒傑偣傫丅
堐帩婜帯椕偵偼嵟揔側栻嵻偺堦偮偲尵偊傑偡偑丄嵞敪梊杊傗媫惈憺埆帪偺巊梡曽朄偵偮偄偰偼専摙拞偺傛偆偱偡丅
暃嶌梡偑彮側偔丄崅偄暈栻傾僪僸儔儞僗偑摼傜傟傗偡偄偱偡丅
|
|
EPS 抶敪惈僕僗僉僱僕傾 |
崅僾儘儔僋僠儞寣徢 |
懱廳憹壛 |
摐戙幱堎忢 |
崅帀幙寣徢 |
QTc墑挿 |
夁捔惷 |
掅寣埑 |
峈僐儕儞惈暃嶌梡 |
|
僙儗僱乕僗 |
亄亄亄 |
亄亄亄 |
亄 |
0 |
0 |
0 |
亄亄 |
0 |
0 |
|
儕僗僷僟乕儖 |
亄 |
亄亄亄 |
亄亄 |
亄亄 |
亄亄 |
亄 |
亄 |
亄 |
0 |
|
僕僾儗僉僒 |
0 |
.0 |
亄亄亄 |
亄亄亄 |
亄亄亄 |
0 |
亄 |
亄 |
亄亄 |
|
僙儘僋僄儖 |
0 |
0 |
亄亄 |
亄亄 |
亄亄 |
0 |
亄亄 |
亄亄 |
0 |
|
僄價儕僼傽僀 |
0 |
0 |
0 |
0 |
0 |
0 |
亄 |
0 |
0 |
僙儘僋僄儖偼摐擜昦偺婛墲楌偺偁傞姵幰偵嬛婖偱偁傞偙偲偼桳柤偡偓偰彂偔昁梫偑柍偄偱偟傚偆丅
摐擜昦偺壠懓楌偑偁偭偨傝丄嫬奅宆摐擜昦偱偁偭偨傝丄旍枮傗崅帀幙寣徢偑偁傞応崌偱傕丄怲廳搳梌偲側傝傑偡丅
SGA搳梌奐巒屻6儢寧埲撪偵摐擜昦敪徢偑懡偄偲偺偙偲偱偡丅
乮曗懌乯堄奜側栻偑寣摐傪忋徃偝偣傞偙偲偑偁傝傑偡丅NQ偱偡丅寣摐傪忋徃偝偣傞壜擻惈偺偁傞栻嵻傪乽億働僢僩堛栻昳廤乿偱傑偲傔偰偍偒傑偟傚偆丅
億僀儞僩俇
峈旕掕宆峈惛恄昦栻偺暪梡偵偮偄偰峫偊傞丅
亙掕宆峈惛恄昦栻亜
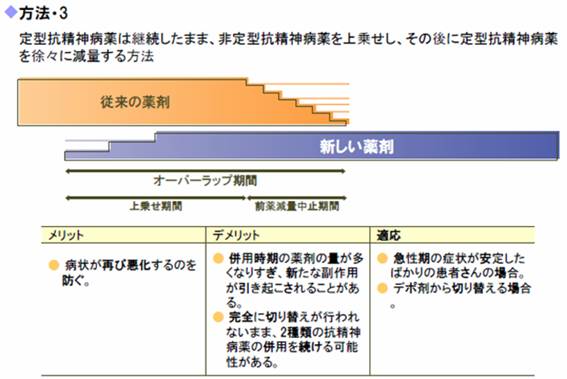
掕宆峈惛恄昦栻偟偐巊偊側偐偭偨帪偵偼丄峈惛恄昦栻傪丄尪妎丒栂憐偵嫮偄帯椕嶌梡傪帵偡崅椡壙峈惛恄昦栻乮僴儘儁儕僪乕儖側偳乯丄捔惷嶌梡偺嫮偄掅椡壙峈惛恄昦栻乮儗儃儊僾儘儅僕儞側偳乯丄偄傢備傞晩妶嶌梡傪桳偡傞栻暔乮僗儖僺儕僪側偳乯偺3孮偵傢偗丄姵幰偺徢忬偵傛偭偰偙傟傜3孮偺栻傪巊偄暘偗偨傝慻傒崌傢偣偨傝偡傞偲偄偆懡嵻暪梡傪惓摉壔偡傞棟榑偑偁傝傑偟偨丅掕宆峈惛恄昦栻偱偼崅椡壙栻偲掅椡壙栻偺慻傒崌傢偣偼奀奜偱傕峴傢傟偰偍傝丄摿偵晄壐傗晄柊傪敽偆徢椺偵偍偄偰椪彴揑桳梡惈傕崅偄偲巚傢傟傑偡丅
亙旕掕宆峈惛恄昦栻亜
戞擇悽戙峈惛恄昦栻偑暪梡偝傟偰偄傞偙偲傪丄偳偺傛偆偵曔傜偊偨傜偄偄偺偱偟傚偆偐丠
2005擭搙偵擔杮偱峴傢傟偨偁傞2偮偺戝婯柾挷嵏偱丄擖堾偍傛傃奜棃偲傕栺15%偺姵幰偱SGA摨巑偺暪梡搳梌偑偝傟偰偄傞偲偝傟偰偄傑偡丅
尰帪揰偱丄SGA摨巑傪暪梡偡傞偙偲偺桳岠惈偵偮偄偰丄DBT偵傛傝徹柧偝傟偨偙偲偼偁傝傑偣傫丅SGA摨巑偺暪梡偼丄懠偺帯椕朄偑偡傋偰柍岠偱偁偭偨帪偵峴偆傕偺偱丄憗偄抜奒偱峴偆帯椕偲偼偄偊側偄偲偄偆偺偑尰嵼偺堦斒揑側擣幆偲巚偄傑偡丅SGA摨巑偺暪梡偼丄TMAP摑崌幐挷徢帯椕傾儖僑儕僘儉偱傕乽stage丂6乿偲偄偆嵟廔僗僥乕僕丠偱弶傔偰偱偰偔傞帯椕朄偱偡丅
億僀儞僩俈
僗僀僢僠儞僌乮愗傝懼偊乯偺曽朄偵偮偄偰棟夝偡傞丅
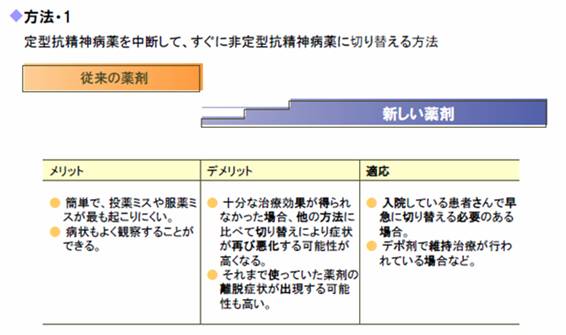
桳岠惈偑廫暘偱偼側偄丄暃嶌梡偑弌偰偄傞側偳偺棟桼偱丄懠偺峈惛恄昦栻傊偺愗傝懼偊乮亖僗僀僢僠儞僌乯傪峴偆偙偲偑偁傝傑偡丅僗僀僢僠儞僌偺曽朄偼庡偵俉偮偵戝暿偱偒傑偡丅
乮1乯 慜栻傪僗僷僢偲傗傔傞偐丠彊乆偵慟尭偟偰拞巭偡傞偐丠
乮2乯 怴偨偵捛壛偡傞栻嵻傪廫暘検偱奐巒偡傞偐丠慟憹偡傞偐丠
乮3乯 慜栻偲怴偨側栻嵻傪暪梡偡傞婜娫偑偁傞偐丄側偄偐丠
偺2x2x2亖8捠傝偲偄偆傢偗偱偡丅椪彴偺応偱庡偵巊梡偝傟偰偄傞僗僀僢僠儞僌偺僷僞乕儞偼師偺3捠傝偱偡丅

僗僀僢僠儞僌偵偍偗傞廳暋搳梌婜娫偼悢廡娫乣悢儢寧偱姰椆偟傑偡丅徢忬偑埨掕偟側偄応崌偼偙傟傛傝挿偔側傞偙偲偼側偄偲峫偊傑偡丅側偤側傜丆悢儢寧宱偭偰傕怴偨偵捛壛偟偨栻嵻偺岠壥偑側偄偲偄偆偙偲傪帵偟偰偄傞偲峫偊傞偐傜偱偡丅
偙偺姵幰偼4儢寧娫摨偠梡検偱堐帩偟偰偄傞偺偱僗僀僢僠儞僌偺僆乕僶乕儔僢僾婜娫偲偟偰偼挿偡偓傑偡丅
乮暅廗乯億僀儞僩俀峈惛恄昦栻偺岠壥敪尰帪婜偵偮偄偰棟夝偡傞丅
峈惛恄昦栻偺昡壙偼丄懡偔偺帯椕僈僀僪儔僀儞偱彮側偔偲傕4廡娫丄挿偔偰10廡娫偺娤嶡婜娫傪偍偔偙偲傪悇彠偟偰偄傑偡丅峈惛恄昦栻偵傛傞峈尪妎栂憐岠壥偼搳梌奐巒屻1-2廡娫偟偰尰傟丄廫暘側岠壥傪擣傔傞傑偱偵彮側偔偲傕4廡娫埲忋傪梫偡傞偲峫偊傜傟傑偡丅
EPS偺弌尰丄尪妎偺徚幐偑偱偒側偄側偳偺棟桼偐傜丄愗傝懼偊搑拞偱徢忬偑埨掕偟偨応崌丄暪梡張曽偺傑傑宱夁傪傒傞偲偡傞徢椺曬崘傪尒傞偙偲傕偁傝傑偡偺丆偦偺壜擻惈偼偁傞偐傕偟傟傑偣傫丅
僙儘僋僄儖偺搳梌検偼200mg偲彮側傔偱偁傝丄傑偨峈惛恄昦嶌梡偺嫮偝偼堦斒揑偵儕僗僷僟乕儖亜僙儘僋僄儖偱偁傞偙偲傪峫偊傞偲丄儊僀儞偺栻嵻偼儕僗僷僟乕儖偱丄崱傂偲偮懌傝側偄岠壥傪暃嶌梡偺彮側偄僙儘僋僄儖偱曗偭偰偄傞偲偄偆姶偠偑偟傑偡丅
僙儘僋僄儖偼丆乽峈惛恄昦嶌梡偵壛偊丆擣抦婡擻傗偆偮偵懳偡傞岠壥偑婜懸偝傟丒丒丒乿偲崱擔偺帯椕栻偵彂偐傟偰偄傞傛偆偵丆峈惛恄昦嶌梡埲奜偺嶌梡傪婜懸偟偰儕僗僷僟乕儖偵忋忔偣偝傟偰偄傞壜擻惈偑堦斣崅偄偲峫偊傑偡丅
億僀儞僩俉慟尭偺昁梫惈偵偮偄偰棟夝偡傞丅
戅栻徢岓乮棧扙徢忬丒儕僶僂儞僪乯偺弌尰偵拞巭偟傑偡丅
D2-R偺幷抐夝彍丄mAch-R偺幷抐夝彍丄H1-R幷抐夝彍偼丄峈惛恄昦嶌梡偺埆壔丄晄柊丒EPS偺埆壔丄晄柊傪堷偒婲偙偡壜擻惈偑偁傝傑偡丅峈惛恄昦栻偩偗偺戅栻徢岓偩偗偱偼側偔丄暃嶌梡偺偨傔偵巊梡偝傟偰偄傞峈僐儕儞惈僷乕僉儞僜儞栻偺戅栻徢岓偵傕拲堄偟傑偡丅
億僀儞僩俋
峈惛恄昦栻偼偄偮傑偱堸傒懕偗傞偺偐丠
徢忬偑埆壔偟偨偲偒偩偗栻偺堸傔偽偄偄偺偐丠乮亖娫寚搳梌偺桳岠惈偼乯
偵偮偄偰姵幰偵愢柧偱偒傞傛偆偵偡傞丅
僈僀僪儔僀儞偵採帵偝傟偰偄傞峫偊曽傪俀偮徯夘偟傑偡丅栻偼堸傒懕偗側偗傟偽側傜側偄丆側偐側偐傗傔傞偙偲偼偱偒側偄丆偲偄偆偺偑尰忬偱偡丅
| 暷崙惛恄堛妛夛帯椕僈僀僪儔僀儞乮2004擭乯 姲夝偟偨弶敪僄僺僜乕僪姵幰側偄偟暋悢僄僺僜乕僪傪帩偮姵幰偵懳偡傞嵟傕怲廳側帯椕慖戰巿偼丂嘆塱媣偵帯椕傪懕偗傞丂嘇栻暔帯椕偱徢忬偺姲夝偁傞偄偼嵟揔側斀墳偑1擭懕偄偨屻偵暈栻傪拞巭偡傞丅偨偩偟丄拞巭屻傕枾愙側僼僅儘乕傾僢僾偑昁梫丅丂嘊娫寚揑昗揑椕朄偲斾傋丄堐帩椕朄偺曽偑嵞敪偑彮側偄丂嘋塱懕揑側峈惛恄昦栻偺堐帩椕朄偼丄婛偵暋悢偺僄僺僜乕僪傪帩偭偰偄傞姵幰丄傑偨偼5擭埲撪偵2夞偺僄僺僜乕僪傪帩偭偰偄傞姵幰偵懳偟偰悇彠偝傟傞 |
| 擔杮乽惛恄堛妛島嵗扴摉幰夛媍丂摑崌幐挷徢帯椕僈僀僪儔僀儞乮2004擭乯乿 嘆弶敪僄僺僜乕僪偱姲夝偵帄偭偨応崌偼12側偄偟24儢寧娫堐帩偟偰丄慟尭拞巭偡傞丅丂嘇嵞敪僄僺僜乕僪偑2夞埲忋傒傜傟偨傝丄徢忬偑帩懕偡傞応崌偵偼偝傜偵挿婜偵傢偨偭偰堐帩偡傞丅2夞埲忋偺嵞敪僄僺僜乕僪偱傕3擭偵傢偨偭偰嵞敪偑側偗傟偽慟尭拞巭傪悇彠偡傞曬崘傕偁傞丅昿夞偺嵞敪僄僺僜乕僪偑偁傞偲偒偼丄惗奤偵傢偨傞挿婜娫偺暈栻宲懕偑昁梫偱偁傞丅嘊娫寚揑搳梌偵娭偟偰偼丂(1)弶夞僄僺僜乕僪偩偗偺応崌傪彍偒丄暋悢偺嵞敪僄僺僜乕僪傪宱尡偟偰偄傞姵幰偵偼憗婜挜岓偩偗傪昗揑偵偡傞娫寚揑側栻暔帯椕偼姪傔傜傟側偄丂(2)弶夞僄僺僜乕僪偱偼娫寚揑側栻暔椕朄傗掅梡検偺堐帩椕朄偼斲掕偝傟偰偄側偄丅 |
嵟屻偵丒丒丒
亙SGA偺拞偐傜偺栻嵻慖戰偺峫偊曽亜
尰嵼丄摑崌幐挷徢偺偡傋偰偺僈僀僪儔僀儞偱戞堦慖戰偼SGA偱偁傞偙偲偼娫堘偄偁傝傑偣傫丅SGA扨嵻偺桳岠惈丒埨慡惈偺斾妑偼丄傑偩廫暘偵峴傢傟偰偄傑偣傫丅尰帪揰偱偼丄SGA偺拞偱偳偺栻嵻傪慖戰偡傞偐偼乬壗偵拝栚偡傞偐丠亖栚偺慜偺姵幰偵偲偭偰壗傪桪愭偵偟偰栻傪慖傇偺偐乭偑廳梫側億僀儞僩偵側傝傑偡丅崱屻丆榞撪偺崁栚傪忢偵堄幆偟側偑傜曌嫮傪恑傔偰偄偔偙偲偑丄SGA傪巊偄偙側偣傞傛偆偵側傞偨傔偺乬僐僣乭偩偲巚偄傑偡丅
| 亙巹偑峫偊傞俽俧俙傪棟夝偡傞偨傔偺億僀儞僩亜 丒弶敪/嵞敪丆媫惈婜/堐帩帯椕婜偺梡朄梡検丆 丒桳岠惈偵娭偡傞斾妑 丒暈栻宲懕婜娫偵娭偡傞桪楎 丒暃嶌梡僾儘僼傽僀儖偺斾妑 丒擣抦婡擻傊偺塭嬁 |
峈惛恄昦栻偺摍壙姺嶼偵偮偄偰
僗僀僢僠儞僌帪偺椡壙姺嶼傗
懡嵻暪梡偵昁梫埲忋偺梡検偺栻嵻偑搳梌偝傟偰偄側偄偐傪尒傞偨傔偵棙梡偟傑偡丅
偄偔偮偐偺栻嵻偵偮偄偰椺帵偟傑偡丅
| 掕宆峈惛恄昦栻 | 旕掕宆峈惛恄昦栻 | |||
| A孮丗崅椡壙孮 | B孮丗掅椡壙孮 | C孮丗堎宆孮 | SDA | MARTA |
| 僙儗僱乕僗2mg | 僐儞僩儈儞100mg | 僗儖僺儕僪200mg | 儕僗僷僟乕儖1mg | 僙儘僋僄儖66mg |
| PZC10mg | 儗儃僩儈儞100mg | |||
嶌惉擔丗2009擭1寧30擔



